AULA 1 - Eletrônica Geral 1 - Técnico
A Eletrônica Geral baseia-se no comportamento especial de alguns materiais semicondutores e seu uso potencial em circuitos de alta e baixa tensão.
Estrutura Atômica
Os átomos, elementos constituintes da matéria, são formados por três elementos básicos:
- Prótons - Carga elétrica positiva;
- Neutrons - Elementos sem carga elétrica;
- Elétrons - Carga elétrica negativa.
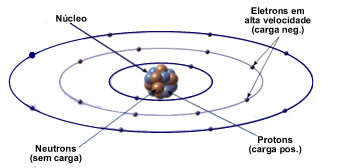
Ao longo da história, muitos cientistas, como Dalton, Thompson, Rutherford e Bohr estudaram a estrutura do átomo e criaram modelos para descrever as partículas subatômicas. O modelo atômico de Rutherford-Bohr, ilustrado na figura acima, define que um átomo é formado por um núcleo, no qual se encontram os neutrons e prótons, componentes estes responsáveis por grande parte do peso atômico, e ao redor do núcleo se encontram os elétrons, estes dispostos em camadas eletrônicas, também conhecidas como níveis de energia.
Neste modelo, os elétrons orbitam ao redor do núcleoo.
Para se manter eletricamente neutro, um átomo precisa possuir a mesma quantidade de elétrons e prótons.
Caso haja diferença entre o número de prótons e elétrons em um átomo, ele apresentará uma carga elétrica líquida, transformando-se em um íon positivo (falta de elétrons) ou um íon negativo (sobra de elétrons).
Assim como em um sistema solar, os elétrons (cargas negativas) são atraídos pelo núcleo (carga positiva) devido à força de atração que cargas de diferentes polaridades possuem entre si.
Relembrando a lei de Coulomb, a intensidade da força de atração entre o núcleo e os elétrons decai com o quadrado da distância entre eles, de modo que os elétrons mais próximos ao núcleo sentem uma força de atração muito maior do que os elétrons dispostos nas camadas mais distantes.
Essa situação faz com que os elétrons que ocupam camadas mais distantes sejam mais afetados pelo efeito de campos elétricos externos ao átomo.
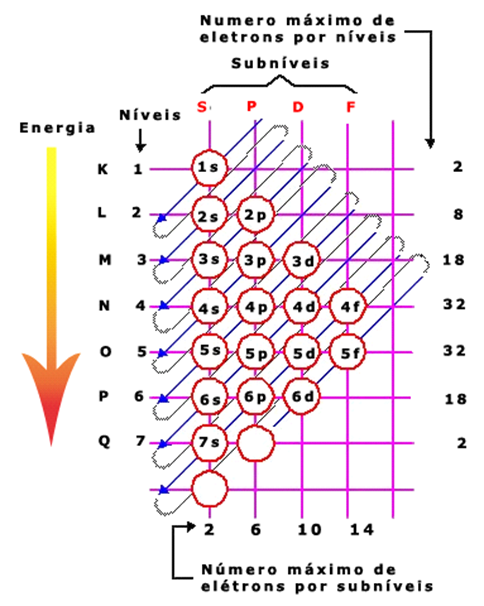
Em relação à quantidade de camadas eletrônicas, o diagrama de Pauling estipula que os átomos podem possuir até 7 camadas, estas denominadas: K, L, M, N , O, P e Q.
Cada camada, no entanto, pode ser ocupada por um número máximo de elétrons, como descreve a Tabela 1.
Tabela 1: Distribuição de Elétrons em Camadas Eletrônicas
| CAMADA ELETRÔNICA | Número Máximo de e- |
|---|---|
| K | 2 |
| L | 8 |
| M | 18 |
| N | 32 |
| O | 32 |
| P | 18 |
| Q | 2 |
Cada camada ainda pode ser dividida em sub-níveis de energia (s, p d e f), os quais
podem ser ocupados também por um número máximo de elétrons.
A Tabela 2 explicita o número máximo de elétrons passíveis de serem alocados em cada nível de energia.
Tabela 2: Distribuição de Elétrons em Sub-níveis de Energia
| SUB-NÍVEL DE ENERGIA | Número Máximo de e- |
|---|---|
| s | 2 |
| p | 6 |
| d | 10 |
| f | 14 |
À medida que as camadas eletrônicas se afastam do núcleo, maior é a energia potencial associada àquela camada, ou seja, menor é a influência da força de atração do núcleo sobre os elétrons das camadas mais exteriores.
A variação da energia contida em cada nível ao longo das camadas é ilustrada na Figura 3, onde as setas indicam a variação de um nível de menor energia para um de maior energia.
A distribuição dos elétrons de um determinado átomo nas camadas também segue a variação da energia mostrada na Figura 3, ou seja, os elétrons se distribuem primeiramente nas camadas mais interiores (com menor energia) e vão subindo para níveis de energia mais altos.
Para exemplificar essa situação considere um átomo de Silício, cujo número atômico é 14 (14 prótons e 14 elétrons), iremos distribuir esses elétrons nas camadas eletrônicas seguindo a orientação da Figura 3.
Tabela 2: Distribuição de Elétrons em Sub-níveis de Energia
| SUB-NÍVEL DE ENERGIA | Número Máximo de e- |
|---|---|
| s | 2 |
| p | 6 |
| d | 10 |
| f | 14 |
Observe que um átomo de Silício possui apenas 3 camadas, sendo a camada M a última camada que contém elétrons.
Neste caso, a última camada ocupada por elétrons é denominada camada de valência.
Notamos que o silício é um átomo tetravalente, isto é, possui quatro elétrons em sua camada de valência.
De acordo com a regra do octeto, o átomo de silício será estável apenas se conseguir adquirir mais quatro elétrons.
Essa aquisição de elétrons ocorrerá por meio do compartilhamento dos elétrons da camada de valência com outros átomos; esse tipo de ligação química é conhecida como ligação covalente
As ligações covalentes permitem a criação de longas redes de átomos dando origem
a cristais de um determinado material.
Quando uma rede é composta apenas por átomos de um mesmo material, aquela rede passa a ser denominada intrínseca.
No caso de haver um grande número de impurezas em uma rede (átomos de outros materiais imersos na rede) chamamos a rede de extrínseca.
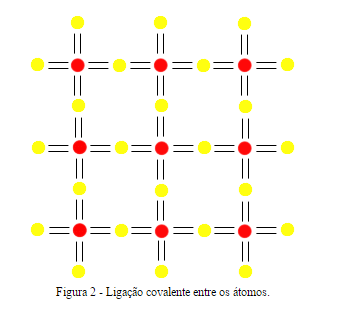
O silício intrínseco será formado idealmente apenas por átomos de silício, os quais fazem ligações covalentes com outros átomos vizinhos, como ilustra a Figura 3, nota-se que um elemento do cristal de silício possui um formato tetraédrico.
Classificação dos materiais segundo a condutividade
Do ponto de vista da Eletrônica, os materiais podem ser classificados como:
- Isolante – é um condutor de eletricidade muito pobre;
- Metal – é um excelente condutor de eletricidade;
- Semicondutor – possui condutividade entre os dois extremos acima.
Semicondutores
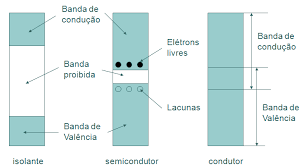
Assim como existem materiais condutores e materiais isolantes, existe um tipo de material que é um meio termo entre esses dois primeiros. Esse material é o semicondutor. O semicondutor, portanto, possui um nível de condutividade entre os extremos de um isolante e um condutor.
Na Figura 2, há uma representação entre os tipos de materiais em relação a sua condutividade.
Um semicondutor permite a passagem de corrente sob certas circunstâncias, e este comportamento é que permitiu que a eletrônica evoluísse a altos níveis tecnológicos.
Os materiais semicondutores mais usados na indústria eletrônica são o Germânio (Ge) e o Silício (Si), apesar do Silício predominar a produção atualmente. Seu comportamento se deve à sua ligação química, chamada ligação covalente (por compartilhar elétrons). Na Figura 1.2, há uma ilustração da estrutura bidimensional para este elemento.
A rede cristalina entre os átomos de silício são formadas através de ligações covalentes entre elementos.
O material básico utilizado na construção de dispositivos eletrônicos semicondutores, em estado natural, não é um bom condutor, nem um bom isolante.