AULA 1 - Eletrônica Geral 1 - Técnico
A Eletrônica Geral baseia-se no comportamento especial de alguns materiais semicondutores e seu uso potencial em circuitos de alta e baixa tensão.
Estrutura Atômica
Os átomos, elementos constituintes da matéria, são formados por três elementos básicos:
- Prótons - Carga elétrica positiva;
- Neutrons - Elementos sem carga elétrica;
- Elétrons - Carga elétrica negativa.
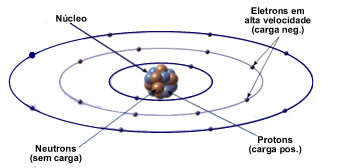
Ao longo da história, muitos cientistas, como Dalton, Thompson, Rutherford e Bohr estudaram a estrutura do átomo e criaram modelos para descrever as partículas subatômicas. O modelo atômico de Rutherford-Bohr, ilustrado na figura acima, define que um átomo é formado por um núcleo, no qual se encontram os neutrons e prótons, componentes estes responsáveis por grande parte do peso atômico, e ao redor do núcleo se encontram os elétrons, estes dispostos em camadas eletrônicas, também conhecidas como níveis de energia.
Neste modelo, os elétrons orbitam ao redor do núcleoo.
Para se manter eletricamente neutro, um átomo precisa possuir a mesma quantidade de elétrons e prótons.
Caso haja diferença entre o número de prótons e elétrons em um átomo, ele apresentará uma carga elétrica líquida, transformando-se em um íon positivo (falta de elétrons) ou um íon negativo (sobra de elétrons).
Assim como em um sistema solar, os elétrons (cargas negativas) são atraídos pelo núcleo (carga positiva) devido à força de atração que cargas de diferentes polaridades possuem entre si.
Relembrando a lei de Coulomb, a intensidade da força de atração entre o núcleo e os elétrons decai com o quadrado da distância entre eles, de modo que os elétrons mais próximos ao núcleo sentem uma força de atração muito maior do que os elétrons dispostos nas camadas mais distantes.
Essa situação faz com que os elétrons que ocupam camadas mais distantes sejam mais afetados pelo efeito de campos elétricos externos ao átomo.
Distribuição de elétrons e níveis de energia
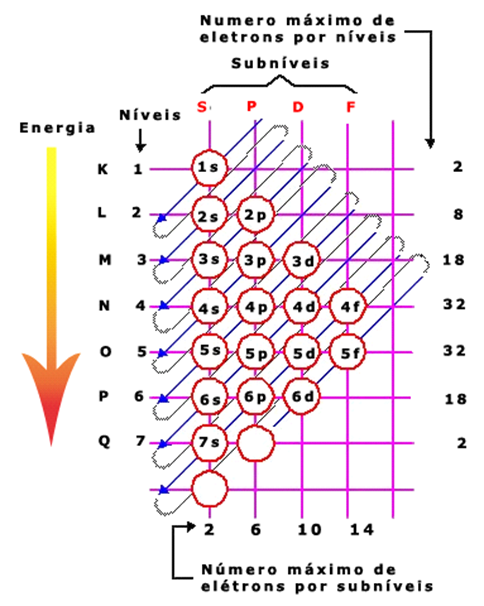
Em relação à quantidade de camadas eletrônicas, o diagrama de Pauling estipula que os átomos podem possuir até 7 camadas, estas denominadas: K, L, M, N , O, P e Q.
Cada camada, no entanto, pode ser ocupada por um número máximo de elétrons, como descreve a Tabela 1.
Tabela 1: Distribuição de Elétrons em Camadas Eletrônicas
| CAMADA ELETRÔNICA | Número Máximo de e- |
|---|---|
| K | 2 |
| L | 8 |
| M | 18 |
| N | 32 |
| O | 32 |
| P | 18 |
| Q | 2 |
Cada camada ainda pode ser dividida em sub-níveis de energia (s, p d e f), os quais
podem ser ocupados também por um número máximo de elétrons.
A Tabela 2 explicita o número máximo de elétrons passíveis de serem alocados em cada nível de energia.
Tabela 2: Distribuição de Elétrons em Sub-níveis de Energia
| SUB-NÍVEL DE ENERGIA | Número Máximo de e- |
|---|---|
| s | 2 |
| p | 6 |
| d | 10 |
| f | 14 |
À medida que as camadas eletrônicas se afastam do núcleo, maior é a energia potencial associada àquela camada, ou seja, menor é a influência da força de atração do núcleo sobre os elétrons das camadas mais exteriores.
A variação da energia contida em cada nível ao longo das camadas é ilustrada na Figura 3, onde as setas indicam a variação de um nível de menor energia para um de maior energia.
A distribuição dos elétrons de um determinado átomo nas camadas também segue a variação da energia mostrada na Figura 3, ou seja, os elétrons se distribuem primeiramente nas camadas mais interiores (com menor energia) e vão subindo para níveis de energia mais altos.
Para exemplificar essa situação considere um átomo de Silício, cujo número atômico é 14 (14 prótons e 14 elétrons), iremos distribuir esses elétrons nas camadas eletrônicas seguindo a orientação da Figura 3.
Tabela 3: Distribuição de Elétrons do átomo de Silício em Sub-níveis de Energia
| CAMADA | s | p | d | f |
|---|---|---|---|---|
| K | 2 | |||
| L | 2 | 6 | ||
| M | 2 | 2 |
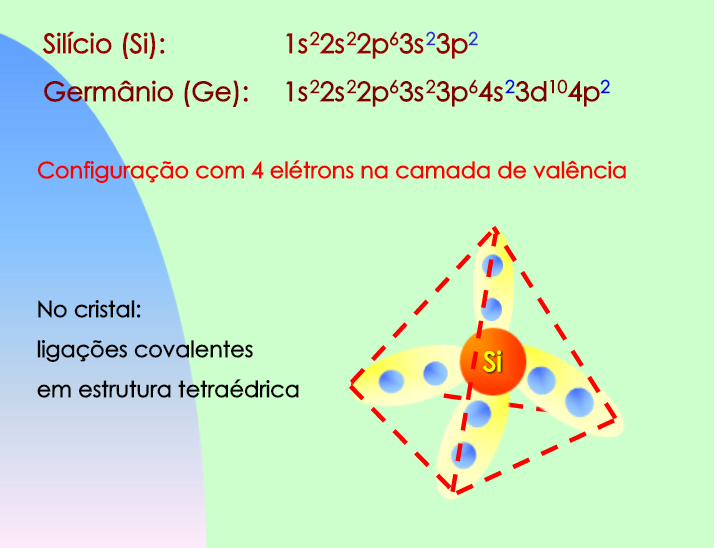
Observe que um átomo de Silício possui apenas 3 camadas, sendo a camada M a última camada que contém elétrons. Neste caso, a última camada ocupada por elétrons é denominada camada de valência.
Notamos também que o silício é um átomo tetravalente, isto é, possui quatro elétrons em sua camada de valência.
De acordo com a regra do octeto, o átomo de silício será estável apenas se conseguir adquirir mais quatro elétrons.
Essa aquisição de elétrons ocorrerá por meio do compartilhamento dos elétrons da camada de valência com outros átomos; esse tipo de ligação química é conhecida como ligação covalente
Ligações Covalentes
As ligações covalentes são ligações químicas caracterizadas pelo compartilhamento de elétrons entre átomos.
Esse tipo de ligação tende a ser mais forte que outros tipos de ligações, como a iônica, onde ocorre doação, e não compartilhamento de e-. Ao contrário das ligações iônicas, nas quais os íons são mantidos unidos por atração coulômbica não direcional, ligações covalentes são altamente direcionais. Como resultado, Moléculas covalentemente ligadas tendem a formar-se em um número relativamente pequeno de formas características, exibindo ângulos de ligação específicos. Em outras palavras, ligações covalentes permitem a criação de longas redes de átomos dando origem a cristais de um determinado material.
Quando uma rede é composta apenas por átomos de um mesmo material, aquela rede passa a ser denominada intrínseca.
No caso de haver um grande número de impurezas em uma rede (átomos de outros materiais imersos na rede) chamamos a rede de extrínseca.
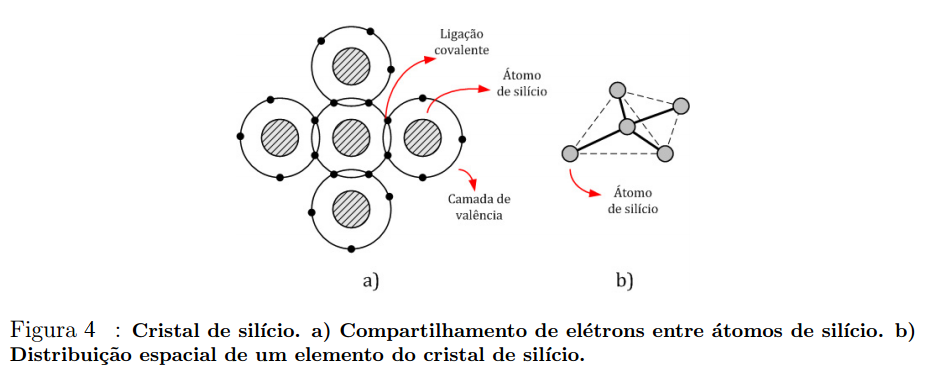
O silício intrínseco será formado idealmente apenas por átomos de silício, os quais fazem ligações covalentes com outros átomos vizinhos, como ilustra a Figura 4.
Nota-se que um elemento do cristal de silício possui um formato tetraédrico.
Como comentado, os e- de um determinado átomo se encontram dispostos em camadas eletrônicas, distribuídos de acordo com a energia potencial associada a cada um deles.
A física quântica explica com propriedade que existem níveis discretos de energia associados a cada uma das camadas eletrônicas, o que implica em se dizer que:
um elétron pertencente a um átomo não pode apresentar qualquer valor de energia potencial, mas sim, níveis bem definidos pela estrutura atômica.
Isso faz com que existam, entre as camadas eletrônicas, bandas de energia proibidas, ou seja, as quais nunca serão ocupadas por elétrons.
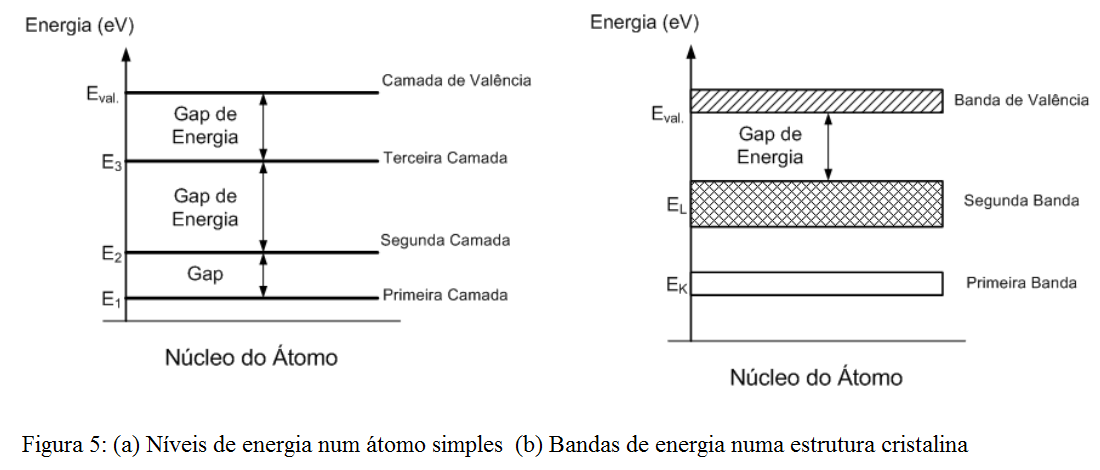
Uma banda proibida entre duas camadas eletrônicas é chamada de Gap de energia.
O gap determina a quantidade de energia potencial necessária para que um elétron de uma determinada camada possa ”pular” para uma outra camada.
Normalmente a energia associada a um e- é medida em eV (elétron.volt), onde:
1 eV = 1, 6 × 10−19 [J]
A Figura 5a) ilustra os níveis de energia associados a um átomo simples, isolado. Mas, como já foi citado, átomos costumam se dispor em redes cristalinas, formadas pela associação de diversos átomos. A interação de um átomo com os seus vizinhos na rede cristalina altera a composição dos níveis de energia, uma vez que estes também dependem da posição de cada átomo na rede.
Essa alteração age no sentido de se expandir o nível de energia, formando bandas de energia, como ilustra a Figura 5b).
Os e- da banda de valência são aqueles que menos sentem a força de atração exercida pelos seus respectivos núcleos.
Caso estes e- recebam uma quantidade de energia suficientemente grande para vencer essa força de atração, eles irão se tornar elétrons livres, isto é, não estarão mais ligados ao seu átomo de origem, podendo então circular pela rede cristalina livremente.
Esse estado de energia no qual um elétron se torna um e- livre é tratado como uma nova banda de energia, acima da banda de valência, chamada de banda de condução.
Elétrons na banda de condução estão mais suscetíveis à ação de campos elétricos, podendo portanto participar na condução de corrente elétrica.
OBS: Quando um e- atinge a banda de condução, tornando-se livre, ele deixa um buraco na sua ligação covalente de origem. Esse buraco ou lacuna pode ser ocupado eventualmente por um e- próximo, o que produzirá uma nova lacuna em um outro ponto do material. Para fins de estudo de eletrônica, criou-se um artifício matemático que trata a lacuna como um elemento atômico próprio, tendo carga positiva e ligado à banda de valência, ou seja, essa produção de novas lacunas no material é vista como uma corrente de lacunas na banda de valência.
Para se compreender o artifício que é a lacuna, imagine que a rede cristalina é uma sala completamente cheia, com pessoas sentadas em cadeiras. Se por algum motivo uma pessoa quiser sair, ela deixará uma cadeira vazia. Essa pessoa pode ser enxergada como um e- livre, pois não está presa a nenhuma posição fixa na rede cristalina. A cadeira vazia seria o equivalente à lacuna deixada pelo e-.
Imagine agora que essa cadeira vazia fosse ocupada por uma outra pessoa, que deixou o seu lugar de origem, notaremos que a cadeira vazia agora estará em um outro ponto da sala. Neste contexto, poderíamos avaliar o movimento das pessoas que se deslocam na sala, assim como poderíamos estudar o movimento das cadeiras vazias, o que fosse mais conveniente.
A quantidade de e- livres presentes na banda de condução, para um determinado
material, depende principalmente do gap de energia existente entre a banda de condução e
a de valência. Cada material possui um perfil de gap diferente, o que influi diretamente na
condutividade do material.
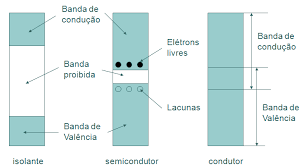
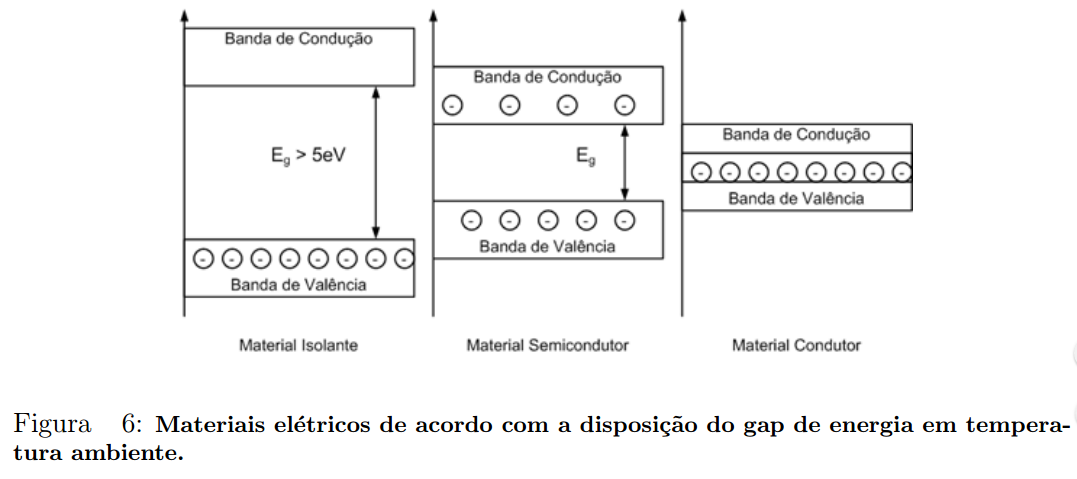
A Figura 6 mostra o perfil do gap de energia para materiais ditos condutores, isolantes e semicondutores.
Classificação dos materiais segundo a condutividade
Do ponto de vista da Eletrônica, os materiais podem ser classificados como:
- Isolante – é um condutor de eletricidade muito pobre;
- Metal – é um excelente condutor de eletricidade;
- Semicondutor – possui condutividade entre os dois extremos acima.
Isolantes
Quanto maior for a largura da banda proibida, menor será a condutividade elétrica numa dada temperatura.
Dessa maneira, a distinção entre semicondutores e isolantes está na largura da banda proibida. Para semicondutores, ela é pequena, enquanto para isolantes ela é relativamente grande.
Metais
Os metais possuem uma estrutura química tal que os e- de valência não estão associados a um determinado átomo. Pelo contrário estes circulam por todo o metal.
Os e- de valência dos metais são designados de e- livres e são os responsáveis pela corrente elétrica. Assim, apenas o fenômeno de deriva que permite formação de corrente.
Semicondutores
Assim como existem materiais condutores e materiais isolantes, existe um tipo de material que é um meio termo entre esses dois primeiros. Esse material é o semicondutor.
Os semicondutores não são bons nem maus condutores de eletricidade, na verdade a sua condutividade depende da exposição à luz, temperatura e do acréscimo de impurezas, aos quais ele está submetido. Por exemplo, um cristal de silício se comporta como um isolante perfeito a temperatura de -273º C. À medida que a temperatura vai aumentando, sua condutividade também aumenta.
Na Figura 6, há uma representação entre os tipos de materiais em relação a sua condutividade.
e
Onde Eg é a energia do gap.
Para alguns materiais semicondutores temos:
- Ge - Eg = 0, 67 eV ;
- Si - Eg = 1, 1 eV ;
- GaAs - Eg = 1, 41eV .
Nota-se que em temperatura ambiente os materiais isolantes não apresentarão nenhum, ou quase nenhum elétron na banda de condução, constituindo uma baixa condutividade.
Os materiais semicondutores apresentarão poucos elétrons na banda de condução, sendo a ocupação dessa banda fortemente dependente da temperatura.
Em altas temperaturas um semicondutor possuirá muitos elétrons livres, aproximando-se de um material condutor.
A baixas temperaturas essa quantidade diminui, aproximando o material de um isolante.
Os materiais condutores, por sua vez, apresentam um entrelaçamento das bandas de condução e valência, implicando em se ter um grande número de e- livres, ou seja, uma alta condutividade.
OBS: Em materiais semicondutores, o aumento da temperatura do material confere maior energia aos e- da banda de valência, fazendo com que a quantidade de e- que atingem a banda de condução aumente. Com isso, pode-se dizer que a condutividade de materiais semicondutores aumenta com a temperatura, ao contrário dos materiais condutores, os quais perdem condutividade com o aumento da temperatura. Dizemos que os materiais semicondutores possuem coeficiente de temperatura NEGATIVO, enquanto os condutores possuem coeficiente de temperatura POSITIVO.
Os materiais semicondutores mais usados na indústria eletrônica são o Germânio (Ge) e o Silício (Si), apesar do Silício predominar a produção atualmente.
O silício e o germânio são átomos tetravalentes, pois possuem quatro elétrons na camada de valência.
O potencial necessário para tornar livre qualquer um dos elétrons de valência é menor que o necessário para remover qualquer outro da estrutura.
Os elétrons de valência podem absorver energia externa suficiente para se tornarem elétrons livres.